打开文本图片集
摘要:通过花药形态和细胞学观察,以测定磺酰脲类除草剂苯磺隆对甘蓝型油菜中双2号育性的影响。结果表明,苯磺隆诱导处理的花药在形态上发生明显改变,花药皱缩、干瘪缺水、颜色淡黄、纤维丝薄短、紧连蜜腺管底端、不形成花粉粒等;绒毡层的破坏是导致甘蓝型油菜雄性不育的主要原因。
关键词:苯磺隆;油菜;花药;细胞学观察
中图分类号:S565.401文献标志码: A文章编号:1002-1302(2015)09-0128-02
油菜是人们日常生活所需食用油和调味料的重要资源,还可作为一种蔬菜。利用杂种优势是提升农作物产量和价值的重要技术[1-2],而油菜在产量和一些农艺性状方面具有显著的杂种优势。阻止母本自我受精虽然降低了农作物种子的纯度,但对杂种的获得具有重要的意义。开发利用雄性不育亲本是确保母本异型杂交和大规模获得F1代杂交种子的重要途径。张宝娟等研究表明,通过叶面喷施15~20 mL磺酰脲类除草剂苯磺隆(TM)2次,能诱导甘蓝型油菜中双9号完全不育,且高效稳定,是一种较好的油菜化学杀雄剂[3]。本研究通过苯磺隆诱导油菜品种中双2号,对其花药进行形态和细胞学观察,为揭示化学药物诱导油菜雄性不育的机制提供形态和细胞学依据。
1材料与方法
1.1材料
适合于河北省种植的冬性甘蓝型油菜品种中双2号,由中国农业科学院油料作物研究所提供;化学杀雄剂75%苯磺隆水分散粒剂,由江苏江南农化有限公司生产。
1.2处理方法
2013年9月初,将油菜定植在大田,株行距为0.1 m×0.5 m;11月中旬,将油菜从大田移植到温室,温室条件:温度为16~23 ℃,湿度为65~75%,光照16 h左右;在油菜抽薹高度为15~20 cm、最大花蕾长度为1~2 mm时,按苯磺隆最佳用药量15~20 mL/单株,采用小型手动喷雾器均匀喷施于油菜叶片表面,以喷清水为对照。
1.3细胞学观察
采用石蜡切片法对花药进行细胞学观察。石蜡切片法流程采用李正理的方法[4],将油菜稳定的可育和不育性花序在双蒸水 ∶无水乙醇 ∶醋酸为6 ∶3 ∶1的改良卡诺固定液中固定24 h;分别用30%、50%、70%、80%、95%、100%乙醇从低浓度到高浓度进行梯度脱水;用二甲苯进行透明,浸56~58 ℃石蜡,包埋;对石蜡块进行固着和整修,用Leica EM UC7超薄切片机进行切片,切片厚度为1 μm;明胶黏贴剂黏片,37 ℃烘干超过24 h;苏木精染色,阿拉伯树胶封片,Olympus BX51显微镜观察,获得70 nm超微结构,用JEM-1230型透射电子显微镜进行拍照。
2结果与分析
2.1形态观察
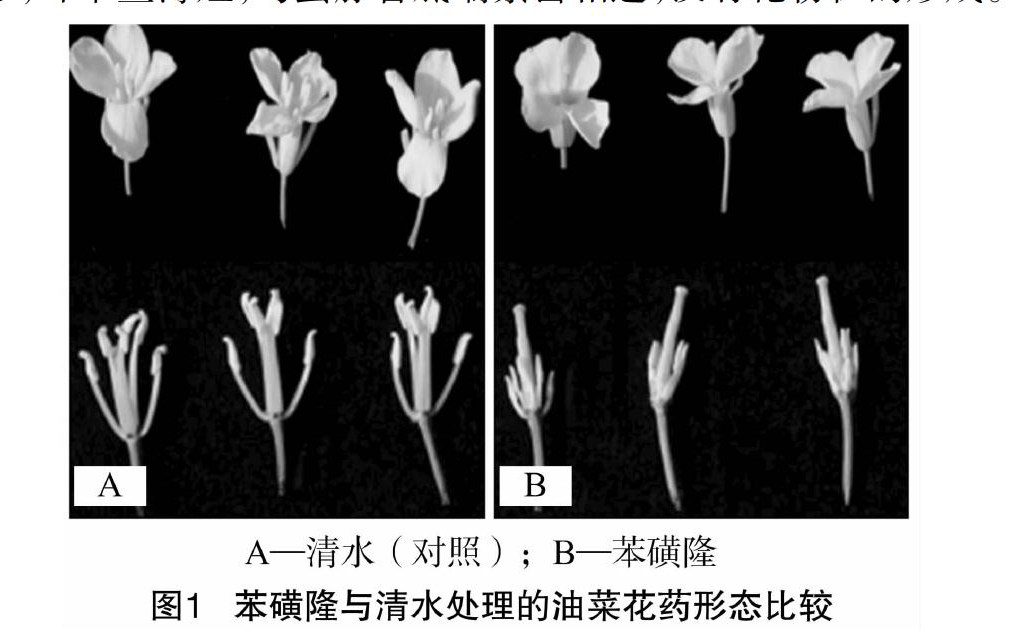
由图1可见,正常发育的油菜花药(喷清水)生长良好,长而丰满,花粉粒数量众多;苯磺隆诱导处理的油菜,雌蕊显著长于雄蕊,花药发育较差,呈淡黄色,皱缩,呈干燥的三角形,纤维丝薄短,与蜜腺管底端紧密相连,没有花粉粒的形成。
2.2细胞学观察
在花粉母细胞、四分体、单核细胞、成熟期4个发育时期,对中双2号油菜花药的细胞结构进行观察。由图2可见,在花粉母细胞时期,喷清水处理的油菜花药,细胞结构包括1层源表皮、药室内壁、中层及绒毡层,细胞质的染色较均匀(图2-A);苯磺隆诱导药物处理的油菜花药,细胞源表皮、药室内壁、中层细胞没有发生明显变化,花粉母细胞的数量和形态也未发生改变,绒毡层虽然保持完整性,但有大量蓝色物质聚集在绒毡层细胞中央,周围形成空泡结构(图2-B),与清水处理的花药有明显差别;在四分体时期,苯磺隆处理的油菜花药绒毡层细胞遭到不同程度破坏,与对照(图2-C)相比,其花药虽然包括有完整的绒毡层,但细胞质聚合成块,周围形成空泡状,细胞数量和排布密度都有很大程度降低(图2-D);在单核期,清水处理的花药小孢子出现空泡化,绒毡层也发生退化,这是单核晚期的表现(图2-E),而苯磺隆诱导处理的花药,其细胞绒毡层发生异常,大小不一,退化延迟,且无细胞核,小孢子细胞发生畸变而无活性(图2-F);在成熟期,清水处理的花药中已经形成许多去空泡化、可育的小孢子,绒毡层还存在,但已经发生退化(图2-G),而苯磺隆处理的花药绒毡层已经消失不见,小孢子数量很少,即使形成小孢子,也呈空泡化状,呈现败育性状(图2-H)。
3结论
苯磺隆属于乙酰乳酸合酶抑制剂,是一类非常重要的磺酰脲类除草剂[5],目前对其杂草清除的生化和分子机制已经进行了深入研究[6]。苯磺隆还是一种可高效诱导甘蓝型油菜完全雄性不育的化学杀雄剂[3,7-8],但当前对其诱导植物雄性不育的细胞学机制还不是十分明确。
通过光学显微镜和透射电子显微镜观察分析苯磺隆诱导处理的油菜花药细胞学形态发现,在花粉母细胞、四分体、单核细胞、成熟期4个发育时期,都能观察到花药细胞有缺陷的绒毡层,花粉母细胞时期绒毡层细胞的细胞质浓缩聚集,形成空泡状结构,绒毡层细胞在单核期退化延迟。除此之外,在苯磺隆诱导处理的花药中,还观察到一些畸变的小孢子,最终导致成熟期花粉的败育,与Cheng等研究结论[9-10]较为相似。这可能是因为苯磺隆诱导处理油菜花药,使各个时期绒毡层的细胞发育异常,包括提早分裂、绒毡层与中间层剥离、延迟降解等,不能提供正常花粉发育所需的成分,形成败育的小孢子,从而诱导油菜雄性不育,这种化学药物诱导的油菜雄性不育,其花药细胞学特性不同于受特定育性相关基因调控的细胞质雄性不育和细胞核雄性不育[11-12]。
参考文献:
[1]李培武,丁小霞,张文,等. 甘蓝型油菜叶片硫甙含量的杂种优势研究[C]//湖北省植物生理学会第十五次学术研讨会论文集,2007:63-68.
[2]傅廷栋. 杂交油菜的育种与利用[M]. 武汉:湖北科学技术出版社,1995.
[3]张宝娟,赵惠贤,胡胜武. 苯磺隆对甘蓝型油菜中双9号的杀雄效果[J]. 中国油料作物学报,2010,32(4):467-471.
[4]李正理. 植物制片技术[M]. 2版.北京:科学出版社,1987:90-92.
[5]Zhou Q Y,Liu W P,Zhang Y S,et al. Action mechanisms of acetolactate synthase-inhibiting herbicides[J]. Pesticide Biochemistry and Physiology,2007,89(2):89-96.
[6]Das M,Reichman J R,Haberer G,et al. A composite transcriptional signature differentiates responses towards closely related herbicides in Arabidopsis thaliana and Brassica napus[J]. Plant Molecular Biology,2010,72(4/5):545-556.
[7]Yu C,Hu S,He P,et al. Inducing male sterility in Brassica napus L. by a sulphonylurea herbicide,tribenuron-methyl[J]. Plant Breeding,2006,125(1):61-64.
[8]胡海兵. 化学除草剂诱导甘蓝型油菜雄性不育效果与生理机制研究[D]. 雅安:四川农业大学,2012:14-27.
[9]Cheng Y,Wang Q,Li Z,et al. Cytological and comparative proteomic analyses on male sterility in Brassica napus L. induced by the chemical hybridization agent monosulphuron ester sodium[J]. PLoS One,2013,8(11):e80191.
[10]井苗,董振生,严自斌,等. BHL等4种药物对油菜杀雄效果的研究[J]. 西北农业学报,2008,17(3):165-170.
[11]González-Melendi P,Uyttewaal M,Morcillo C N,et al. A light and electron microscopy analysis of the events leading to male sterility in Ogu-INRA CMS of rapeseed (Brassica napus)[J]. Journal of Experimental Botany,2008,59(4):827-838.
[12]Xiao Z D,Xin X Y,Chen H Y,et al. Cytological investigation of anther development in DGMS line Shaan-GMS in Brassica napus L.[J]. Czech Journal of Genetics and Plant Breeding,2013,49(1):16-23.